Em nossa vida diária, encontramos reações químicas lentas (como, por exemplo, a queima de uma vela) e rápidas (por exemplo, a explosão da dinamite). Daí surge o estudo da cinética química.
Mas o que é a cinética química?
Cinética química é o estudo da velocidade das reações químicas e dos fatores que nela influem.
1.1. Conceito de velocidade média da reação
Velocidade média de uma reação química é o quociente da variação da concentração molar (ou molaridade) de uma das substâncias, dividida pela variação do tempo.
Dada a reação química:
A + B → C + D
e chamando por :
∆ Mc = ∆[C] = diferença entre a molaridade final e a molaridade inicial da substância C.
(Na cinética química é comum indicar a molaridade com o uso de colchetes; assim, por exemplo, [HCl] indica a molaridade do HCl numa solução.)∆t = varição do tempo
teremos:
velocidade média da reação {vm = ∆[C]/ ∆t
em relação à substância C
EXEMPLO 1
Se na reação acima a concentração de C passar de 20,0 para 32,5 mols/litro do 5º para o 10º minuto de reação, diremos que a velocidade média da reação, em relação a C, foi:
- no intervalo do 5º ao 10º minuto: vm = 32,5 - 20,0/ 10 - 5 → vm = 2,5 mols/L x min
1.2. Conceito de velocidade instantânea da reação
Velocidade da reação num determinado instante (ou velocidade instantânea) é o limite da velocidade média quando o intervalo de tempo tende a zero.
Para a reação A + B → C + D, temos, então, em relação ao produto C:
velocidade instantânea: v = lim ∆[C]/∆t
∆t → 0
Como este limite corresponde matematicamente a uma derivada, podemos também definir:
Velocidade da reação num determinado instante (ou velocidade instantênea) é a derivada da concentração molar de uma substância, em relação ao tempo.;
Isto é:
v = d[C]/ dt
A ideia de velocidade instantânea de uma reação é semelhante à ideia de velocidade instantânea de um automóvel, que nós lemos no velocímetro do carro. Em Química também existem aparelhos automáticos que nos permitem ler a velocidade de uma reação a cada instante.
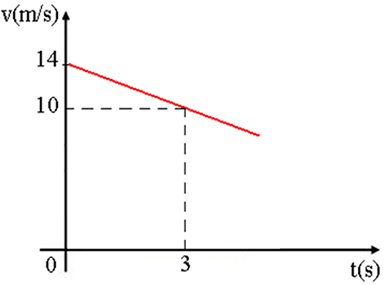
A velocidade instantânea de uma dada reação diminui com o tempo. Traçando o gráfico da velocidade em função do tempo, temos:
Observação:
Tanto a velocidade média como a velocidade instantânea das reações podem também ser expressas pelas variações de massa ou de número de mols ou das pressões parciais (em se tratando de gases), etc., por unidade de tempo (segundo, minuto, hora, etc.).
EXEMPLO 2
(Faap-SP) Num dado meio onde ocorre a reação N2O5 à N2O4 + ½ O2, observou-se a seguinte variação na concentração de N2O5 em função do tempo:
N2O5 (mol/L)
|
0,233
|
0,200
|
0,180
|
0,165
|
0,155
|
Tempo (s)
|
0
|
180
|
300
|
540
|
840
|
Calcule a velocidade média da reação no intervalo de 3 a 5 min.
Resolução:
Vm= -∆[N2O5]/ ∆t → Vm = - 0,180 - 0,200/ 300 - 180 → Vm = 0,000166 mol/L.s
ou
Vm = -0,180 - 0,200/ 5-3 → Vm = 0,01 mol/L.min
Observação:
Neste problema foi dada a variação da concentração de N2O5, que é o reagente da reação. Sendo assim, a concentração [N2O5] diminui com o tempo e, portanto, a variação ∆ [N2O5] torna-se negativa. Para evitar que a velocidade dê um resultado negativo, opta-se por "corrigir" a fórmula da velocidade colocando-se o sinal (-), em sua expressão matemática, sempre que a velocidade se refere aos reagentes da reação.
EXEMPLO 3
(Faap-SP) A reação de decomposição de iodidreto é representada pela equação química
2HI ß à I2 + H2
O controle da concentração de iodidreto presente no sistema, em função do tempo (em temperatura constante) forneceu os seguintes dados:
Iodidreto(mol/L)
|
1
|
0,625
|
0,375
|
0,200
|
0,120
|
Tempo (min)
|
0
|
10
|
20
|
30
|
40
|
A velocidade dessa reação é constante? Por que?
Resolução: A velocidade não é constante; ela diminui com o tempo, bastando verificar que, na tabela, para intervalos iguais de tempo (10 min), a variação da concentração molar de iodidreto diminui com o tempo.
Fonte: Fundamentos da Química, de Ricardo Feltre
top
ResponderExcluir